В недавнем исследовании Nature Aging оценивается эффективность сенолитической терапии на основе химерных антигенных рецепторов (CAR) Т-клеток. При этой терапии сенолитические CAR-Т-клетки нацелены на урокиназный рецептор активатора плазминогена (uPAR) -позитивные клетки, которые накапливаются в процессе старения.
 Исследование: Профилактическая и длительная эффективность сенолитических CAR-Т-клеток против возрастной метаболической дисфункции. Фото предоставлено Хуаном Гертнером / Shutterstock.com
Исследование: Профилактическая и длительная эффективность сенолитических CAR-Т-клеток против возрастной метаболической дисфункции. Фото предоставлено Хуаном Гертнером / Shutterstock.com
Предыстория
Клеточное старение — это необратимая остановка клеточного цикла, которая вызывается в ответ на стресс. В условиях стресса вырабатываются ферменты ремоделирования матрикса и провоспалительные цитокины, которые называются секреторным фенотипом, ассоциированным со старением (SASP).
У молодых людей с физиологическими состояниями, такими как подавление опухоли и заживление ран, SASP способствует привлечению иммунных клеток, которые способствуют восстановлению тканей и удалению стареющих клеток. У пожилых людей накапливаются стареющие клетки из-за снижения функционирования иммунной системы и более сильного повреждения тканей.
На сегодняшний день большинство сеноилатических методов лечения включают низкомолекулярные препараты, которые требуют многократного введения и плохо воздействуют на пораженный регион. Для сравнения, CAR-Т-клеткам требуется единственный целевой антиген, экспрессия которого отличается от экспрессии в нормальных тканях. Кроме того, CAR-Т-клетки представляют собой однократно вводимые ‘живые лекарства’, которые сохраняются в течение многих лет и опосредуют их действие.
Об исследовании
Ранее было показано, что CAR-Т-клетки нацелены на белок клеточной поверхности uPAR и эффективно разрушают стареющие клетки. В текущем исследовании изучается, эффективно и безопасно ли CAR-Т-клетки удаляют стареющие клетки у пожилых мышей, регулируя тем самым продолжительность жизни.
В исследование были включены мыши обоих полов в возрасте 8-12 недель и 18-20 месяцев. Они содержались в групповых условиях содержания, свободных от патогенов.
Использовался 12-часовой цикл «свет / темнота», а условия температуры и влажности были стандартными. Стареющие мыши питались обычной пищей, тогда как подгруппа мышей потребляла диету с высоким содержанием жиров (HFD).
Для анализа методом проточной цитометрии печень диссоциировали и фильтровали с последующим лизисом эритроцитов. Было выполнено секвенирование одноклеточной рибонуклеиновой кислоты (РНК) с последующим размножением, выделением и трансдукцией мышиных Т-клеток. Были проведены полные замеры крови и посмертный анализ нескольких органов.
Основные выводы
Было показано, что сенолитическая клеточная терапия смягчает симптомы, связанные с физиологическим старением, включая метаболическую дисфункцию. С этой целью доля uPAR-позитивных клеток часто увеличивается с возрастом; следовательно, как иммунные, так и неиммунные uPAR-позитивные клетки, вероятно, облегчают бремя старения в старых тканях.
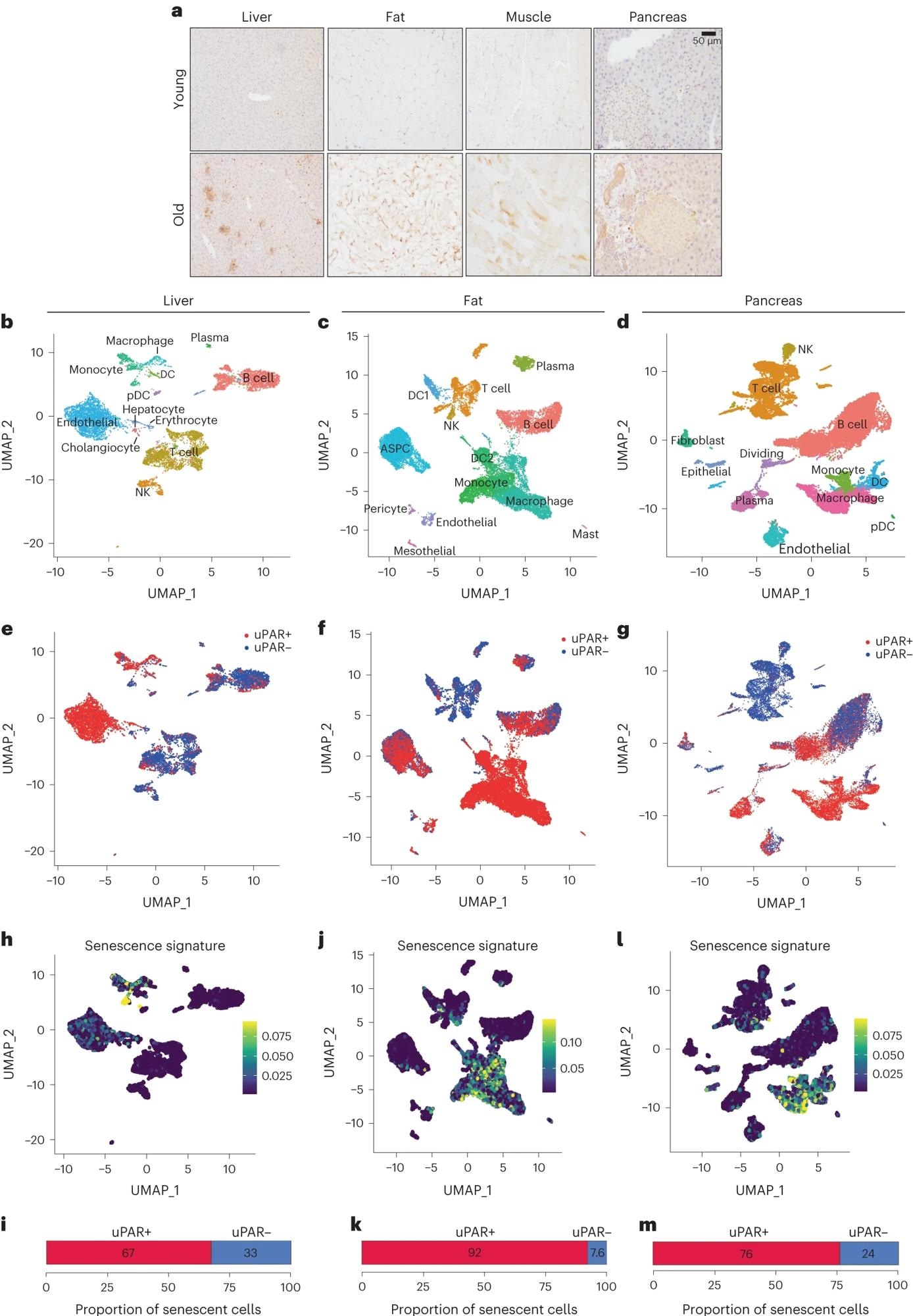
a, Иммуногистохимическое окрашивание мышиного uPAR в печени, жировой ткани, мышцах и поджелудочной железе у молодых (возраст 3 месяца) или старых (возраст 20 месяцев) мышей (n = 3 на возраст). b–m, одноклеточный анализ экспрессии uPAR и старения. uPAR-положительные и uPAR-отрицательные клетки были выделены из печени, жировой ткани и поджелудочной железы 20-месячных мышей и подвергнуты одноклеточному РНК-секвенированию по протоколу 10x chromium (n = секвенирование четырех мышей, где две самки были объединены в одну копию, а два самца — в другую копию). b, визуализация типов клеток печени с равномерной аппроксимацией и проекцией (UMAP). c, визуализация типов клеток жировой ткани с использованием UMAP. d , UMAP-визуализация типов клеток поджелудочной железы. e, UMAP-визуализация uPAR-негативных и uPAR-позитивных типов клеток печени. f, UMAP-визуализация жировых uPAR-негативных и uPAR-позитивных типов клеток. g, UMAP-визуализация uPAR-негативных и uPAR-позитивных типов клеток поджелудочной железы. h,j,l, UMAP-визуализация с оценкой признаков старения24 в каждой ячейке, обозначенной цветовой шкалой. i,k,m, Количественная оценка доли uPAR-позитивных и uPAR-негативных клеток, способствующих соответствующему старению. h,i — печень; j, k — жировая ткань; l, m — поджелудочная железа. Результаты взяты из одного независимого эксперимента (a–m). DC — дендритные клетки; NK — естественные киллеры; pDC — плазмоцитоидные дендритные клетки; ASPC — жировые клетки-предшественники и стволовые клетки.
Также была отмечена эффективность CAR-Т-клеток uPAR в удалении uPAR-позитивных стареющих клеток. С этой целью эффективность uPAR CAR-Т-клеток не связана с патологией тканей или изменениями параметров почек и печени у пожилых мышей.
Было обнаружено, что действие uPAR CAR-Т-клеток связано с метаболической приспособленностью и повышенным гомеостазом глюкозы у нормально стареющих мышей, которых кормили HFD. Важно отметить, что после введения uPAR CAR-Т-клеток в рекомендованных дозах токсичности не наблюдалось.
Способность CAR-Т-клеток uPAR действовать профилактически для смягчения связанного с питанием и возрастом снижения метаболизма была еще одним поразительным наблюдением. Более того, uPAR CAR-Т-клетки оказывают длительное воздействие на сенолитические методы, основанные на малых молекулах. После однократного введения эти клетки нарушали связанный с HFD или индуцированный возрастом метаболический синдром у мышей, которым вводили HFD, или у тех, кого лечили в молодости.
Что касается толерантности к глюкозе, сенолитические исследования выявили удаление стареющих бета-клеток поджелудочной железы. Однако старение иммунных клеток также могло сыграть свою роль.
Также было предложено элиминацию макрофагов со стареющими признаками для смягчения разрушения тканей у мышей. Это согласуется с наблюдениями исследования, в котором доля uPAR-экспрессирующих макрофагов совместно экспрессирует транскрипционные сигнатуры, связанные со старением, и ассоциированную со старением β-галактозидазу (SA-β-gal).
Выводы
Механизм действия малых молекул часто плохо изучен; однако сенолитические CAR-Т-клетки имеют четкий механизм, лежащий в основе, благодаря экспрессии специфических поверхностных антигенов. Этот подход связан с многочисленными преимуществами по сравнению с вакцинацией или низкомолекулярными подходами, поскольку клеточная терапия регулирует персистенцию с помощью различных конструкций CAR и оснащена определенными предохранительными переключателями.
В будущем клеточная терапия может быть нацелена на эти антигены для лечения различных фенотипов. Длительность эффекта и персистенция CAR-Т-клеток, нацеленных на uPAR, после однократного введения являются хорошим предзнаменованием для сенолитического CAR Т-клеточного подхода к лечению хронических патологий.



